В целях обеспечения функционирования сайта и проведения статистических исследований и обзоров осуществляется автоматический сбор информации о файлах cookie и IP-адресах. Нажимая кнопку «Согласен» или продолжая использовать сайт, Вы даете согласие на использование данных технологий для нашего сайта.
Клинические исследования. Исторические факты
В связи с распространением нового вируса и пандемией во всем мире в 2020 году очень часто стали звучать словосочетания «клинические исследования» вакцин или лекарственных препаратов, «первая фаза испытания», «третья фаза испытания», регистрация препарата и многие другие.
Но, не связанные с медициной люди, да и многие кто имеет медицинское образование и работает в системе здравоохранения порой тоже ничего не знают ни про клинические исследования, ни про то, как лекарственные препараты попадают на «рынок» и почему одни из них хорошо помогают, а другие не приносят никакого заявленного результата и многие другие вопросы, касающиеся лекарственных препаратов.
В данной статье мы немного коснемся истории возникновения клинических исследований лекарственных препаратов и потребности (доказательная медицина- что это?) в данных исследований.
Доказательная медицина не является новой наукой, а представляет собой новую технологию сбора, анализа и интерпретации научной информации.
Доказательная медицина – это использование результатов лучших клинических исследований для выбора лечения конкретного пациента, это интеграция лучших научных доказательств с клиническим опытом и ожиданиями пациентов.
Ø В 1747 году корабль, врач Британского флота Джеймс Линд, патрулировал Атлантический океан в районе Бискайского залива.
Через некоторое время среди матросов началась цинга, и он поставил эксперимент, в котором нашёл средство для её лечения. Линд разделил 12 матросов на шесть групп по два человека.
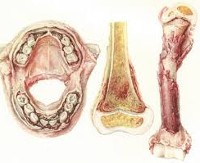
Основным физическим симптомом цинги является распад тела. Разваливаться начинается всё, кожа - начиная с маленьких пузырьков крови, геморрагической сыпи и сильной кровоточивости десен вследствии ломкости сосудов. Затем дёсны начинают разлагаться и становятся черными, быстро выпадают зубы. Начинают болеть все старые раны и травмы. Доходит до того, что начинают исчезать хрящи, например между ребер в области грудной клетки. Снова расходятся старые переломы. Из-за этого больные часто описывают симптомы, как общий болезненный скрип по всем теле. Из-за распада структуры мозга начинаются галлюцинации.
Все они питались одинаково, только первая группа получала кварту сидра ежедневно, другая получала двадцать пять капель купороса, третья — шесть ложек уксуса в день, четвёртая — половину пинты морской воды, пятая — два апельсина и лимон, шестая — пряную пасту или напиток из ячменной воды. Лечение пятой группы закончилось через шесть дней, когда кончились фрукты, но к этому времени они почти полностью выздоровели. Эффект лечения продемонстрировала также первая группа.
Через несколько лет Линд опубликовал работу «Трактат о цинге», в которой на основе своих исследований изложил всё, что он знал о заболевании от других авторов, описал свои эксперименты, основанный на них метод профилактики и лечения, а также собственные рассуждения о причинах заболевания.
Идеи Линда не встретили поддержку, поскольку противоречили убеждениям высокопоставленных влиятельных докторов, в виду устоявшегося мнения об инфекционной природе данного заболевания, долгое время Линд подвергался критике со стороны видных британских медиков.
И лишь спустя почти 2 века, в 1932 году, было доказано, что цинга вызывается исключительно недостатком витамина C и ничем иным. Это открытие было удостоено Нобелевской премии по физиологии или медицине.
Ø 11 января 1922 года умирающий от сахарного диабета пациент, Леонард Томпсон (14 лет), добровольно получил инъекцию инсулина, недостаточно, правда очищенную, что привело к недостаточному развитию эффекта и появлению аллергии. Вскоре 23 января, после повторной инъекции (лучше очищенной), молодому человеку стало намного лучше, и он в последствии прожил до 1935г.
Ф. Бантингу и Дж. Маклеоду была присуждена Нобелевская премия о физиологи и медицине, которую они разделили с Ч. Бестом и Дж. Коллипом. Эра инсулинотерапии и клинической практики началась!
До середины XX века, по сути, никакой регуляторной базы для исследований не было, а возникла она после нескольких крупных скандалов в сфере применения недостаточно исследованных препаратов.
Ø Одним из самых резонансных стал случай с Сульфаниламидом. В 1937 году компания M. E. Massengill решила выпустить жидкую форму препарата для детей. Сульфаниламид плохо растворим в обычных растворителях, поэтому для его растворения были опробованы различные вещества, из которых наиболее подходящим оказался диэтиленгликоль - ядовитый растворитель входящий, в частности, в состав антифризов. Доклинические и клинические исследования не проводились. В октябре 1937 года в FDA ( Food and Drug Administration, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США) поступило сообщение о смерти 8 детей и 1 взрослого пациента после приёма препарата. Компания-производитель разослала 1100 телеграмм, было дано предупреждение по радио и в газетах, подняты на ноги все 239 инспекторов FDA и местная полиция. Был организован поиск покупателей по адресам на рецептах. В кратчайшие сроки препарат был изъят из продажи, однако тот, который был уже продан, унес жизни 107 человек, большинство из которых были дети.
Одной из основных причин, побудивших мировую общественность разработать всеобщие правила проведения клинических исследований, стала трагедия с талидомидом, произошедшая в конце 50-х – начале 60-х годов.
Ø В ходе испытаний лекарства на животных, в частности мышах, препарат показал себя исключительно с лучшей стороны и не выявил никаких побочных эффектов, в том числе у потомства. При применении же препарата у беременных женщин в качестве средства против бессонницы и токсикоза привело к рождению более 10 000 детей по всему миру с дефектами трубчатых костей и конечностей. После этого стало очевидно, что лекарства должны проходить полноценные тесты и исследования, а опыт отдельных специалистов не может быть достаточным основанием для регистрации препарата.
Мы коснулись только некоторых случаев из истории, но из них видно, как шла наука к четким требованиям, которые были приняты в правила и законы.
В 1964 году была разработана и подписана Хельсинская декларация. Она, разработанная Всемирной медицинской ассоциацией, представляет собой набор этических принципов для медицинского сообщества, касающихся экспериментов на людях:
· Добровольное участие;
· Разъяснение всех побочных и других эффектов;
· Риск не должен превышать пользу от применяемого лекарственного средства;
· Субъект исследования должен прочитать и понять в каком исследовании ему предлагают участвовать.
С 1981 по 1992 год присоединяются к декларации Америка, Япония, Англия, Франция и формируется GCP (Good clinical practice) как основное руководство по проведению клинических исследований.
В 1996 году правила проведения клинических исследований ICH GCP официально публикуются под эгидой всемирной организации здравоохранения (WHO).
В 2005 году Россия приняла данный стандарт как основной документ по проведению клинических исследований в виде ГОСТ Р 52379-2005 Надлежащая клиническая практика.
Несмотря на пандемию, продолжающую бушевать в мире и уже оказавшую воздействие практически на все сферы нашей сегодняшней жизни, количество разрешений на проведение клинических исследований в России за первое полугодие 2020 года не на много меньше чем в предыдущие годы ( с января по июнь включительно Минздравом было выдано 302 разрешения на клинические исследования, что на 12,7% меньше, чем за тот же период годом ранее, когда было выдано 346 разрешений).
Клинические исследования новых лекарственных препаратов не являются самоцелью для фармацевтических компаний.
Клинические исследования во всем мире – один из обязательных этапов разработки препарата, предшествующий его регистрации и широкому медицинскому применению.
В ходе клинических исследований фармкомпании всесторонне изучают новый препарат, чтобы получить данные о его эффективности и безопасности.
На основании этих данных уполномоченный орган здравоохранения (в России это Минздрава РФ) принимает решение об одобрении препарата или отказе в регистрации. Препарат, не прошедший клинические исследования, не может быть зарегистрирован и выведен на фармацевтический рынок.
В настоящее время те препараты, которые не показывают доказанную терапевтическую эффективность или поступают новые данные (пострегистрационные исследования) о побочных явлениях, которые противоречат безопасности могут быть отозваны из продажи, тем самым государство строго следит за безопасностью лекарственных средств на своей территории.
Автор материала:
Журавлева Елена Сергеевна,
главная медицинская сестра обособленного медицинского подразделения "КоМед" контрактно-исследовательской организации ООО "Лиганд ресерч"



Комментарии
0